はじめに
統合失調症薬ソリアンを改良したSEP-4199という薬について要望があったので書きます。
おそらくSEP-4199の抗うつ効果がどれ位かなどを中心に書けば、要望に答えることになると思われます。 それ位しかできませんが、ご了承ください。
うつにも色々あって抑うつ気分、うつ状態、うつ症状、うつ病、大うつ病性障害、などがあります。厳密に言うと、これらは全て別物らしいのですが、だいたいは似ているらしいです。
この記事では、躁うつ病のうつ状態に対する臨床試験の有効性データを書きます。
たぶん、発達障害に伴ううつへの有効性なども、今回の治験データから推測できると思います。後で有効性データを書きます。
SEP-4199の誕生
ソリアン(アミスルプリド)には、 S–アミスルプリドとR–アミスルプリドという2つの成分が、50:50 という同じ比率で含まれている。
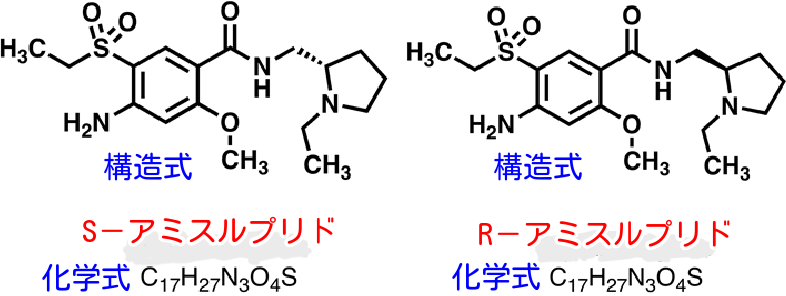
S-アミスルプリドとR-アミスルプリドの構造を見ると、図のように互いに鏡像の関係にある。化学式は同じだが、構造式は若干異なっている。
S-アミスルプリドとR-アミスルプリドは、作用する受容体もやや異なっている。
R-アミスルプリドは、「5HT7受容体」に強く結合し、ki値47の親和性がある。「D2受容体」へはki値140で、やや親和性が弱くなっている。
S-アミスルプリドは逆に、「5HT7受容体」へはki値1900の弱い親和性で、「D2受容体」へはki値4という強い親和性がある。
抗うつ効果を考えた場合、D2受容体遮断作用より、5HT7受容体遮断作用が強い方がいい。
そこで、5HT7受容体をより強く遮断するR-アミスルプリドの量を増やし、D2受容体をより強く遮断する S-アミスルプリドの量を減らして、R:S = 85:15 で混合する事が考えられた。
そのようにして、[R-アミスルプリド:S-アミスルプリド = 50:50]のソリアンを改良し、[R-アミスルプリド:S-アミスルプリド = 85:15]のSEP-4199が作られた。
これによって、抗うつ効果が高められると同時に、D2遮断由来の錐体外路症状も、ソリアン(アミスルプリド)より軽減されている。
ところで、R-アミスルプリドを100%にするのではなく、S-アミスルプリドがいくらか含まれている。
なぜかと言うと、D2受容体遮断作用が持つ、循環器症状、混合型症状、躁転、不安神経症状、精神症状、に対する治療効果を維持するためらしい。

[R-アミスルプリド:S-アミスルプリド = 50:50]のソリアンを改良し、[R-アミスルプリド:S-アミスルプリド = 85:15]のSEP-4199が作られた。
SEP-4199は、ソリアンと比べて、抗うつ効果が高められ、錐体外路症状などが軽減されている。
有効性
SEP-4199は、双極1型に伴ううつ状態へのフェーズ2試験が行われている。主にMADRS(モンゴメリー・アスベルグうつ病評価尺度、マドラス)というものを使って有効性が測定された。
まず、EUの患者と米国の患者、合わせて289名に投与された結果を下の表に示す。
| MADRS 6週間 | プラセボ との差 | 95% 信頼区間 | p値 | 効果量 |
| 200mg | -3.3 | -6.5~-0.1 | 0.054 | 0.31 |
| 400mg | -3.1 | -6.3~0 | 0.054 | 0.29 |
p値を見てみると、200mg投与と400mg投与ともに0.05以下になっていない。つまり、有意な抗うつ効果は示されなかった。
効果量も0.3位で、低いものとなっている。躁うつ病のうつ状態への効果量で、他に知っているものは、ルマテペロンがある。ルマテペロンの場合、効果量は0.56だったので、SEP-4199の効果量は、それより小さい。
また、一般的に効果量は、0.8で大、0.5で中、0.2で小、とされる。SEP-4199の効果量0.3はやはり小さい。
次に、EUの患者と米国の患者に日本の患者を加え、合わせて337名にSEP-4199が投与された結果を下の表に示す。
| MADRS 6週間 | プラセボ との差 | 95% 信頼区間 | p値 | 効果量 |
| 200mg | -3.7 | -6.7~-0.7 | 0.016 | 0.34 |
| 400mg | -3.4 | -6.3~-0.5 | 0.024 | 0.31 |
p値を見てみると、200mg投与と400mg投与ともに0.05以下になっている。なので、こちらは有意な抗うつ効果が示されている。
しかし、効果量は200mgで0.34なので、一般的にも、それ程大きいものではないかもしれない。

SEP-4199の双極うつへの有効性は、サンプルサイズを多くした場合、有意な改善が示されている。しかし、今回の試験では、効果量はあまり大きくなく、大きな抗うつ効果があるのかはわからない。
開発者側によると、今回有効性が低く出たのは、サンプルサイズが少な過ぎた事と、プラセボの改善が不適切に大きく出過ぎたため、とされている。今後のフェーズ3などの結果もよく見ていきたい。
副作用
重度の有害事象は、SEP-4199を200mg投与群で3例、400mg投与群で2例、プラセボ投与群で2例、発生した。
有害事象による投与中止は、200mg群で8.8%、400mg群で7.0%、プラセボ群で1.8%にみられた。
重篤な有害事象は、200mg群で1例(虚血性脳卒中)、プラセボで1例(足の骨折)、400mg群では報告されていない。
これらの事からも、SEP-4199の安全性や忍容性は良好であるとされている。
錐体外路症状の発生率は顕著に低い。SEP-4199の400mg投与群では5.3%発生した。ソリアンの場合、300mg以下の投与で10%、300~600mg投与で19%、600mg以上投与で37%、発生している。
なので、SEP-4199を400mg投与して錐体外路症状が5.3%しか出ないという事は、かなり軽減されている。
躁転は、200mg群で5例(4.4%)、400mg群で1例(0.9%)、プラセボ群で3例(2.6%)、見られた。
6週間の期間の平均体重の増加は、200mg群で0.93kg、400mg群で1.1kg、プラセボ群で0.26kg、だった。
女性の高プロラクチン血症に関する有害事象(乳汁漏出、乳房圧痛、月経遅延)については、200mg群で5.8%、400mg群で7.9%、プラセボ群で0%発生した。
男性のプロラクチン関連の有害事象(勃起・射精障害、性欲減退、女性化乳房など)は発生しなかった。
SEP-4199を400mg投与したグループと、プラセボを投与したグループの有害事象発生件数及び割合を下の表に載せた。
| 400mg | プラセボ | |
| 有害事象の合計 | 56 (49.1%) | 53 (46.5%) |
| QT延長 | 9 (7.9%) | 0 (0%) |
| 眠気 | 5 (4.4%) | 1 (0.9%) |
| 吐き気 | 4 (3.5%) | 3 (2.6%) |
| めまい | 3 (2.6%) | 0 (0%) |
| 便秘 | 2 (1.8%) | 0 (0%) |
| アカシジア | 2 (1.8%) | 0 (0%) |
| 軽躁 | 1 (0.9%) | 1 (0.9%) |
| 下痢 | 0 (0%) | 1 (0.9%) |
| 錐体外路症状 | 5 (4.4%) | 2 (1.8%) |
| プロラクチン関連 | ||
| (女性) | 6/76 (7.9%) | 0/64 (0%) |
| (男性) | 0/38 (0%) | 0/50 (0%) |

SEP-4199は、やはりソリアンより副作用が軽いようだ。
開発状況
SEP-4199は、住友ファーマ、大塚製薬、サノビオン社が共同で開発している。
米国では、2021年9月にサノビオン社が国際共同フェーズ3試験を開始した。
日本でも現在、フェーズ3試験が進行中。2020年代後半の発売が目指されている。
12週間に渡るSEP-4199の長期投与を行った場合の、有効性、安全性、忍容性も調査されている。
SEP-4199CR という、SEP-4199の徐放剤版も開発されているようだ。SEP-4199CRは、服用回数を少なくするための薬だと思う。
追記:その後、フェーズ3試験に参加する患者を集めるのに⼤幅に遅れました。そのため、試験の中⽌が決定されました。現在、⼤塚製薬と開発⽅針検討中だそうです。
まとめ
- [R-アミスルプリド:S-アミスルプリド = 50:50]のソリアンを改良し、[R-アミスルプリド:S-アミスルプリド = 85:15]のSEP-4199が作られた。
- SEP-4199は、ソリアンと比べて、抗うつ効果が高められ、錐体外路症状などが軽減されている。
- SEP-4199は、フェーズ2試験であまり高い有効性を示していない。いろいろ原因があるらしいので、フェーズ3の結果を見て、有効性を見極めたい。
- SEP-4199は、やはりソリアンより副作用が軽い。フェーズ2試験では、錐体外路症状、高プロラクチン血症などが少なかった。
- SEP-4199は、日本では、2020年代後半の発売が目指されている。
コメント
SEP-4199の双極うつへの有効性は、今回あまり高く出なかった。発達障害に伴ううつや、普通のうつ病などに対しても、抗うつ効果は低いという事も考えられる。
けれど、結果が低く出た原因はいろいろあるようだし、開発者側は有望な治療薬と考えているらしい。
今後のフェーズ3試験などで良い結果が出たらいいと思う。
関連記事はこちら。
ソリアン(アミスルプリド、LB-102) /現時点でクロザピンの次に有効性が高い薬
参考文献
- https://pubmed.ncbi.nlm.nih.gov/34727399/
- https://pubmed.ncbi.nlm.nih.gov/33961287/
- https://pubmed.ncbi.nlm.nih.gov/34614447/
- https://www.businesswire.com/news/home/20220105005850/en/Sunovion-and-Otsuka-Initiate-Phase-3-Clinical-Development-of-Non-Racemic-Amisulpride-for-the-Treatment-of-People-with-Bipolar-Depression
- https://www.lelezard.com/en/news-19323247.html
- https://www.otsuka.co.jp/company/newsreleases/2021/20210930_1.html
- https://clinicaltrials.gov/ct2/show/NCT05227209
